SCHEDA LIPU
Picchio rosso maggiore (Dendrocopos major) – Linnaeus, 1758
EURING: 08760
BERNA allegato II
Presente tutto l’anno
Nidificante
LEGENDA
- EURING = Codice EURING
- SPEC = Species of European Conservation Concern (Tucker e Heath, 1994)
- ItRDL = Lista Rossa degli uccelli nidificanti in Italia (Calvario, Gustin, Sarrocco, Gallo-Orsi, Bulgarini e Fraticelli che aggiorna la precedente Frugis e Schenk, 1981; Brichetti & Cambi, 1982)
- 79/409 = Direttiva CEE Uccelli Selvatici
- BERNA = Convenzione di Berna
- BONN = Convenzione di Bonn
Indice
Dendrocopos major
| Picchio rosso maggiore | |
|---|---|
 Maschio adulto di D. m. pinetorum | |
| Stato di conservazione | |
Rischio minimo[1] | |
| Classificazione scientifica | |
| Dominio | Eukaryota |
| Regno | Animalia |
| Phylum | Chordata |
| Classe | Aves |
| Ordine | Piciformes |
| Famiglia | Picidae |
| Genere | |
| Specie | D. major |
| Nomenclatura binomiale | |
| Dendrocopos major (Linnaeus, 1758) | |
| Areale | |
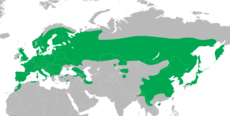
| |
Il picchio rosso maggiore (Dendrocopos major - Linnaeus, 1758) è un picchio di medie dimensioni con il piumaggio bianco e nero e una macchia rossa sulla parte bassa dell'addome. I maschi e i giovani presentano anche macchie rosse sul collo o sulla testa. È diffuso in gran parte dell'Eurasia e in alcune aree del Nordafrica. Nonostante maggior parte del suo areale sia una specie stanziale, gli esemplari delle regioni settentrionali possono effettuare migrazioni in seguito a scarsi raccolti di pigne. Alcuni individui hanno una tendenza innata a vagabondare, e ciò ha portato la specie a ricolonizzare spontaneamente l'Irlanda o a fare la sua comparsa come visitatrice occasionale in Nordamerica. I picchi rossi maggiori usano il becco come uno scalpello per scavare negli alberi in cerca di cibo o per costruire le cavità dove fare il nido, nonché per tamburellare per tenersi in contatto e per segnalare il possesso di un territorio; presentano particolari adattamenti anatomici per fronteggiare gli stress fisici provocati dall'azione di martellamento.
Il picchio rosso maggiore è diffuso in aree forestali di ogni tipo ed ha una dieta molto varia, in quanto è in grado di estrarre semi dalle pigne, larve di insetto dall'interno degli alberi o uova e nidiacei di altri uccelli dai loro nidi. Nidifica in cavità scavate in alberi sia vivi che morti, con il fondo rivestito di trucioli. Ogni covata comprende in genere da quattro a sei uova di colore bianco lucido. Entrambi i genitori si dedicano alla cova, all'alimentazione dei pulcini e alla pulizia del nido. Quando i giovani si levano in volo, per una decina di giorni ancora continuano ad essere nutriti dai genitori, ed ogni genitore nutre parte della nidiata.
Il picchio rosso maggiore è strettamente imparentato con altri membri del suo genere. Presenta un gran numero di sottospecie, alcune delle quali talmente distinte da poter essere considerate potenziali nuove specie. Occupa un areale vastissimo, ha una popolazione molto numerosa e non è minacciato su vasta scala, e viene pertanto classificato come «specie a rischio minimo».
Tassonomia
I picchi costituiscono una famiglia di uccelli molto antica, costituita da tre sottofamiglie, i torcicolli, i e i picchi veri e propri, i . La più numerosa delle sei tribù appartenenti ai Picinae è quella dei cosiddetti picchi bianchi e neri, un gruppo al quale appartiene il picchio rosso maggiore[2]. Tra le numerose specie del genere Dendrocopos, i parenti più stretti del picchio rosso maggiore sono il , il picchio del Sind, il picchio di Siria e il picchio alibianche, nonché, forse, il picchio del Darjeeling[3]. Sono stati segnalati ibridi nati dall'incrocio con il picchio di Siria[1].
Il picchio rosso maggiore venne descritto da Linneo nel suo Systema Naturae del 1758 con il nome di Picus major[4]. È stato successivamente trasferito nel suo genere attuale, Dendrocopos, dal naturalista tedesco Carl Ludwig Koch nel 1816[5]. L'appellativo generico, Dendrocopos, è la combinazione delle due parole greche dendron, «albero», e kopos, «che batte». L'epiteto specifico major, invece, deriva dal latino maior, «maggiore»[6].
Sottospecie
Il numero delle sottospecie di picchio rosso maggiore riconosciute dai vari autori variano molto, da un minimo di 14 a quasi 30. Questo è dovuto al fatto che i cambiamenti sono clinali ed esistono molte forme intermedie. Attualmente le sottospecie riconosciute sono 24:
- D. m. major (Linnaeus, 1758), la sottospecie nominale, diffusa dalla Scandinavia e dalla Polonia nord-orientale fino alla Siberia occidentale;
- D. m. brevirostris (Reichenbach, 1854), diffusa dalla Siberia occidentale a quella orientale, nonché nelle regioni nord-orientali della Cina e in quelle settentrionali della Mongolia;
- D. m. kamtschaticus (Dybowski, 1883), endemica della penisola di Kamchatka;
- D. m. anglicus Hartert, 1900, endemica della Gran Bretagna;
- D. m. pinetorum (C. L. Brehm, 1831), diffusa in Europa centrale;
- D. m. parroti Hartert, 1900, endemica della Corsica;
- D. m. harterti Arrigoni degli Oddi, 1902, endemica della Sardegna;
- D. m. hispanus (Schluter, 1908), diffusa nella penisola iberica;
- D. m. canariensis (A. F. Koenig, 1889), endemica di Tenerife;
- D. m. thanneri le Roi, 1911, endemica di Gran Canaria;
- D. m. mauritanus (C. L. Brehm, 1855), endemica del Marocco;
- D. m. candidus (Stresemann, 1919), diffusa dalla Romania e dalle regioni meridionali dell'Ucraina fino alla Grecia;
- D. m. paphlagoniae (Kummerlöwe e Niethammer, 1935), diffusa nelle regioni settentrionali della Turchia;
- D. m. tenuirostris Buturlin, 1906, diffusa nella regione del Caucaso e nella Transcaucasia;
- D. m. poelzami (Bogdanov, 1879), diffusa nell'Azerbaigian sud-orientale, nell'Iran settentrionale e nel Turkmenistan sud-occidentale;
- D. m. japonicus (Seebohm, 1883), diffusa in Siberia sud-orientale, Cina nord-orientale, Corea e Giappone settentrionale e centrale;
- D. m. wulashanicus Cheng, Xian, Y. Zhang e Jiang, 1975, endemica della Mongolia Interna;
- D. m. cabanisi (Malherbe, 1854), diffusa nelle regioni orientali della Cina;
- D. m. beicki (Stresemann, 1927), diffusa in Cina centrale;
- D. m. mandarinus (Malherbe, 1857), diffusa dalla Cina meridionale e dal Myanmar orientale fino alle regioni settentrionali di Laos e Vietnam;
- D. m. stresemanni (Rensch, 1923), diffusa in India nord-orientale e nel territorio compreso tra il Myanmar nord-orientale, il Tibet sud-orientale e la Cina centro-meridionale;
- D. m. hainanus Hartert e Hesse, 1911, endemica dell'isola di Hainan.
Tuttavia, le analisi del DNA mitocondriale suggeriscono che D. m. poelzami della regione del mar Caspio, D. m. japonicus del Giappone e D. m. cabanisi della Cina potrebbero meritare lo status di specie a tutti gli effetti. Nonostante il suo aspetto caratteristico, invece, D. m. canariensis di Tenerife, nelle isole Canarie, sembra essere strettamente imparentato con la sottospecie nominale D. m. major[3][7].
La sottospecie fossile D. m. submajor visse nel Pleistocene medio durante la glaciazione di Riss (tra 250.000 e 300.000 anni fa) in Europa, a sud della calotta di ghiaccio. Talvolta viene considerata come specie distinta, ma non differisce in modo significativo dal picchio rosso maggiore attuale, le cui sottospecie europee sono probabilmente sue discendenti dirette[8][9].
Descrizione

Il picchio rosso maggiore adulto misura 20-24 cm di lunghezza, pesa 70-98 g ed ha un'apertura alare di 34-39 cm[3][10]. Le regioni superiori sono di colore blu-nerastro, con zone bianche ai lati della faccia e del collo. Dalle scapole si dipartono alcune linee nere che giungono fino alla nuca, alla base del becco e a metà del petto. Sulle scapole vi è una grossa macchia bianca e le penne remiganti sono a strisce bianche e nere, così come la coda. Le regioni inferiori sono bianche, fatta eccezione per una zona scarlatta sul basso ventre e il sottocoda. Il becco è grigio-ardesia molto scuro, le zampe sono grigio-verdastre e l'iride è di colore rosso scuro. I maschi presentano una macchia color cremisi sulla nuca, assente nelle femmine, che per il resto sono molto simili. I giovani hanno un piumaggio meno lucente di quello degli adulti, con sfumature marroni sulle regioni superiori e regioni inferiori di colore bianco sporco. I disegni del piumaggio sono meno definiti che negli adulti e la parte bassa del ventre non è rossa, bensì rosa. I giovani, inoltre, hanno una macchia rossa sulla sommità del capo, meno estesa negli esemplari di sesso femminile[3].
Le varie sottospecie differiscono tra loro per la colorazione del piumaggio e per l'aspetto generale, con le forme settentrionali più grandi e dotate di becco più grosso e regioni inferiori di colore bianco candido; di conseguenza, le sottospecie D. m. major e D. m. kamtschaticus, delle regioni settentrionali dell'Eurasia, sono grandi e sorprendentemente bianche, mentre D. m. hispanicus nella penisola iberica e D. m. harterti in Corsica e Sardegna sono molto più piccole e con regioni inferiori più scure. D. m. canariensis e D. m. thanneri delle isole Canarie sono simili alla forma iberica, ma hanno i fianchi bianchi. In Marocco, gli esemplari di D. m. mauritanus hanno regioni inferiori bianche con del rosso al centro del petto e quelli che nidificano a quote più elevate sono più grandi e scuri di quelli che vivono nelle colline sottostanti. D. m. numidus, che vive in Algeria e Tunisia, ha un aspetto molto caratteristico, con una banda sul petto formata da piume nere rosse all'estremità. La forma del Caspio, D. m. poelzami, è piccola, ha il becco relativamente lungo e regioni inferiori marroni. D. m. japonicus, del Giappone, presenta meno bianco sulle scapole ma di più sulle ali. Le due forme cinesi, D. m. cabanisi e D. m. stresemanni, hanno testa e regioni inferiori marroncine, e spesso un po' di rosso sul petto. In entrambe le razze la colorazione delle regioni inferiori tende gradualmente a divenire più scura man mano che si procede verso il sud dei loro rispettivi areali[3].
Il picchio rosso maggiore è simile ad altre specie del suo genere. Il picchio di Siria è privo della striscia nera sulle guance presente nel suo cugino, ed ha regioni inferiori più bianche e chiazza rossa sulla parte bassa del ventre di colore più chiaro[11]; tuttavia, gli esemplari giovani di picchio rosso maggiore presentano spesso una striscia incompleta sulle guance, il che potrebbe farli scambiare erroneamente per picchi di Siria. Il picchio alibianche ha, come indica il nome, una macchia bianca sulle ali molto più estesa di quella del picchio rosso maggiore[7]. Il picchio del Sind è molto simile al picchio di Siria, e si differenzia dal picchio rosso maggiore per le stesse caratteristiche[11].
Muta
Dopo la stagione della riproduzione, gli adulti di picchio rosso maggiore vanno incontro ad una muta completa che si protrae per circa 120 giorni. Nel Nord, D. m. major inizia la sua muta tra metà giugno e la fine di luglio per terminarla in ottobre o novembre; nelle forme delle zone temperate, come D. m. pinetorum, la muta ha luogo prima, tra inizio giugno/metà luglio e metà settembre/fine ottobre; e la sottospecie meridionale D. m. hispanicus inizia la muta a fine maggio o giugno per finirla in agosto. Nei giovani ha luogo una muta parziale, durante la quale vengono conservate le copritrici alari e rimpiazzate le piume del corpo, della coda e le remiganti primarie. Questa muta, dopo la quale si sviluppa un piumaggio più simile a quello degli adulti, inizia a fine maggio/inizio agosto e termina a metà settembre/fine novembre, variando a seconda della latitudine come nel caso della muta degli adulti[12].
Voce
Il richiamo del picchio rosso maggiore risuona come un kik acuto, che può essere ripetuto fino a creare un suono simile a quello prodotto scuotendo un sonaglio di legno, krrarraarr, quando il volatile viene disturbato. Il richiamo di corteggiamento, gwig, viene emesso soprattutto durante il volo di parata. Questa specie tamburella con il becco su alberi e rami morti, e talvolta, se disponibili, su strutture costruite dall'uomo[3], per mantenersi in contatto con il partner e per dichiarare il possesso del territorio[13].
Entrambi i sessi tamburellano con il becco, ma il maschio lo fa più di frequente, specialmente nel periodo che va dalla metà di gennaio fino al periodo in cui i giovani si levano in volo[3]. Entro i confini del suo areale, quello rosso maggiore è il picchio che tamburella più velocemente, al ritmo di circa 10-16 colpi al secondo[13]; generalmente picchietta in serie della durata di un secondo appena, seppur ripetute frequentemente[14]. Fino agli inizi del XX secolo si riteneva che questi tambureggiamenti fossero prodotti da vocalizzazioni, e fu soltanto nel 1943 che fu infine provata la loro natura puramente meccanica[15].
Distribuzione e habitat

Il picchio rosso maggiore è diffuso in Eurasia dalle isole britanniche al Giappone, e in Nordafrica dal Marocco alla Tunisia, ed è assente solamente da quelle aree troppo fredde o aride per consentire lo sviluppo delle aree boschive che costituiscono il suo habitat preferito[7]. È presente in una grande varietà di foreste, siano esse di latifoglie, di conifere o miste, e in habitat antropizzati, quali parchi, giardini e uliveti. Si incontra dal livello del mare al limite degli alberi, fino a 2000 m in Europa, 2200 in Marocco e 2500 in Asia centrale[3].
Il picchio rosso maggiore è una specie prevalentemente stanziale, ma si possono registrare spostamenti anche notevoli quando vi è scarsità di pigne di pini e pecci nel nord dell'areale[10]. Le popolazioni che vivono ad alta quota spesso discendono verso altitudini inferiori in inverno. Anche i giovani hanno la tendenza ad allontanarsi parecchio dal luogo in cui sono nati, spesso fino a 100-600 km di distanza, talvolta addirittura fino a 3000 km[3]. Esemplari vaganti hanno raggiunto le isole Fær Øer, Hong Kong e l'Islanda[1], e sono stati registrati alcuni avvistamenti anche in Nordamerica, almeno nelle isole Aleutine, nelle isole Pribilof e in Alaska[3].
Il picchio rosso maggiore scomparve dall'Irlanda nel corso del XVII secolo[16], ma l'isola è stata di recente ricolonizzata spontaneamente da questa specie, con una prima nidificazione segnalata nella Contea di Down nel 2007[17]. Da allora l'espansione nell'isola non ha fatto che aumentare, e nel 2013 la sua presenza era stata confermata o perlomeno sospettata in almeno 10 contee, in particolare in quelle di Down e di Wicklow[18]. Le analisi genetiche indicano che gli uccelli ristabilitisi sull'isola sono di origine britannica, piuttosto che scandinava, e che le popolazioni presenti in Irlanda del Nord e nella Repubblica d'Irlanda hanno origini separate[19].
Biologia
Il picchio rosso maggiore trascorre gran parte del suo tempo arrampicato sugli alberi, e presenta numerosi adattamenti per questo stile di vita particolare, molti dei quali condivisi anche da altre specie di picchi. Tra questi ricordiamo la struttura zigodattila del piede, con due dita rivolte in avanti e due all'indietro[20], e le piume rigide della coda che vengono usate come un puntello contro il tronco. Nella maggior parte degli uccelli le ossa della coda diminuiscono di grandezza procedendo verso l'estremità, ma questo non è il caso dei picchi, e l'ultima vertebra, il pigostilo, è molto grande, in modo da consentire l'inserimento dei forti muscoli della coda[21].
L'azione di martellamento dei picchi quando comunicano tamburellando o vanno in cerca di cibo crea grandi forze che potrebbero arrecare potenziali danni a questi uccelli[22]. Nel picchio rosso maggiore e nella maggior parte dei suoi parenti, la cerniera in cui la parte anteriore del cranio si connette con la mandibola è ripiegata verso l'interno, tesa da un muscolo che la protegge dallo shock dell'impatto che si crea quando il becco martella sul legno duro[21]. Lo strato esterno della mandibola superiore è significativamente più lungo della più rigida mandibola inferiore e assorbe gran parte della forza concussiva[23]. Anche vari adattamenti dello scheletro e la sua robustezza contribuiscono ad assorbire l'impatto, e le narici strette rendono più difficile l'inspirazione di detriti volanti[21].
Oltre ad utilizzare cavità per la nidificazione, i picchi rossi maggiori riposano di notte, e talvolta anche durante il giorno, in vecchie cavità nido scavate da altri picchi. Occasionalmente si creano loro stessi una nuova cavità dove riposare o utilizzano strutture artificiali, come le cassette nido[24].
Riproduzione

I picchi rossi maggiori sono fortemente territoriali, e in genere occupano un'area di circa 5 ettari durante tutto l'anno[25], della cui difesa si occupa soprattutto il maschio; tale comportamento di difesa attrae le femmine. Le coppie sono monogame durante il periodo della nidificazione, ma cambiano spesso partner prima della stagione successiva[26].
Il picchio rosso maggiore raggiunge la maturità sessuale ad un anno di età, ed inizia le attività di corteggiamento a partire dal dicembre seguente. Durante la parata nuziale il maschio procede in volo con lenti battiti d'ala e la coda distesa. Mentre vola emette un richiamo particolare e può atterrare presso un possibile nido. La coppia scava una nuova cavità ad almeno 30 cm di altezza dal suolo e generalmente al di sotto degli 8 m, sebbene talvolta possa scavare anche più in alto. Il sito prescelto per il nido è generalmente un albero, vivo o morto, ma può anche essere un palo o una cassetta nido. Le vecchie cavità vengono riutilizzate solo di rado[3], ma la coppia può nidificare sullo stesso albero anche per più anni[26][27]. La cavità del nido è profonda 25-35 cm ed ha un foro d'entrata largo 5-6 cm. Della sua costruzione si occupano entrambi i genitori, ma è il maschio a svolgere la maggior parte del lavoro[3]. Come quello degli altri picchi, il nido non è foderato all'interno, ma la base della cavità può essere ricoperta dai trucioli prodotti durante le attività di scavo[28].

Gli alberi scelti per costruire il nido hanno durame morbido e alburno duro; la morbidezza del durame è dovuta spesso a parassiti o malattie che hanno indebolito il cuore dell'albero. Non sappiamo con certezza come vengano scelti gli alberi adatti, ma è possibile che la selezione venga effettuata tamburellando con il becco, in quanto legni con modulo di elasticità e densità differenti possono trasmettere suoni a differenti velocità. Nel corso di uno studio in Giappone sono stati trovati nidi di questa specie su alberi appartenenti a molte famiglie diverse; tra questi vi erano ontani grigi, , , , salici, larici del Giappone e . Solamente in casi rarissimi furono rinvenuti nidi su alberi di quercia della Mongolia e [29].
Generalmente ciascuna covata è costituita da quattro a sei uova di colore bianco lucido; ogni uovo misura in media 27×20 mm e pesa circa 5,7 g, di cui il 7% è costituito dal guscio[13][30]. La loro deposizione ha luogo tra metà aprile e giugno; a nidificare nel corso di quest'ultimo mese sono gli uccelli che vivono nelle regioni settentrionali dell'areale o ad altitudini elevate[3]. Le uova vengono covate da entrambi i genitori durante il giorno e dal maschio durante la notte[30][26] per 10-12 giorni prima della schiusa. Sia il maschio che la femmina accudiscono e alimentano i pulcini, nudi e inetti, e mantengono pulito il nido. I giovani si levano in volo a 20-23 giorni dalla schiusa. Ogni genitore si assume la responsabilità di nutrire parte della nidiata per circa dieci giorni ancora, durante i quali i giovani rimangono nei pressi dell'albero dove si trova il nido[3].
Il picchio rosso maggiore cresce una sola nidiata all'anno. Il tasso di sopravvivenza di adulti e giovani è sconosciuto, così come la durata di vita media, ma l'età massima registrata da un membro di questa specie superava di poco gli 11 anni[30].
Alimentazione
Il picchio rosso maggiore è onnivoro. Estrae larve di coleotteri dal tronco degli alberi, ma cattura anche molti altri invertebrati, come coleotteri adulti, formiche e ragni. Si nutre inoltre di crostacei, molluschi e carogne, e visita le mangiatoie per uccelli alla ricerca di sego e rifiuti domestici[3]. Può effettuare razzie di uova e pulcini nei nidi di altri uccelli che nidificano nelle cavità degli alberi, come le cince[13]; allo stesso modo può attaccare anche le cassette nido, producendo, se necessario, fori nelle pareti per raggiungere l'interno[31]. In seguito a visite ripetute possono andare distrutte intere colonie di balestrucci[15].
Le sostanze vegetali ricche di grassi, come le noci e i pinoli, sono particolarmente importanti come fonte di cibo invernale per i picchi diffusi nelle regioni settentrionali, e possono soddisfare oltre il 30% del fabbisogno energetico di questi uccelli. Altre sostanze vegetali che vengono consumate sono gemme, bacche e linfa[3]; quest'ultima viene ricavata scavando buchi circolari che formano spesso un anello intorno al tronco di un albero[13].

Il picchio rosso maggiore si alimenta a tutti i livelli di un albero, solitamente da solo, ma talvolta in coppia. In alcuni casi può utilizzare un'«incudine» su cui martellare oggetti duri, in particolare coni di pino, abete e larice, ma anche frutti, noci e insetti dal rivestimento rigido[3].
Gli animaletti facilmente accessibili vengono raccolti dalla superficie dell'albero o da fessure nella corteccia, ma le larve vengono estratte scavando fori fino a 10 cm di profondità e afferrandone il morbido corpo con la lingua, che può estendersi fino a 40 mm oltre il becco ed è ricoperta di setole e saliva appiccicosa per intrappolare la preda[13]. Il picchio è in grado di estendere la lingua in questo modo perché l'osso ioide a cui è collegata presenta lunghi «corni» flessibili che si snodano attorno al cranio e possono muoversi in avanti quando necessario[21][32].
Predatori e parassiti
Il picchio rosso maggiore viene predato da alcuni rapaci della foresta, come lo sparviero eurasiatico e l'astore[33]. Questa specie è uno degli ospiti della mosca ematofaga Carnus hemapterus, e tra i suoi parassiti interni figura l'acantocefalo Prosthorhynchus transversus. I picchi possono ospitare anche protozoi[34], tra i quali anche il potenzialmente letale Toxoplasma gondii, che causa la toxoplasmosi[35]. Il picchio rosso maggiore è l'ospite preferito del cestode Anomotaenia brevis[36].
Conservazione

La popolazione globale del picchio rosso maggiore viene stimata tra 73,7 e 110,3 milioni di individui; in Europa vive il 35% della popolazione. Si stima che il suo areale di nidificazione si estenda su una superficie di 57,8 milioni di km², e la popolazione viene ovunque considerata numerosa e apparentemente stabile o in leggero aumento, specialmente in Gran Bretagna, da dove la popolazione in sovrannumero ha recentemente ricolonizzato l'Irlanda. Per questa serie di motivi il picchio rosso maggiore viene classificato tra le «specie a rischio minimo» (Least Concern) dalla IUCN[1][3].
Nei siti di nidificazione sono state registrate densità variabili tra 0,1 e 6,6 coppie ogni 10 ettari, con un maggior numero di esemplari nelle foreste mature che si sviluppano su terreni alluvionali. In Europa il numero di individui è aumentato a causa della procedura di piantumazione delle foreste, che forniscono habitat perfetti per la riproduzione, e della maggiore disponibilità di legno morto; la specie ha inoltre tratto profitto dalla sua flessibilità per quanto riguarda il tipo di foresta in cui vivere e dalla sua abilità di prosperare in prossimità dell'uomo. Ciononostante, gli inverni rigidi e la frammentazione del manto forestale possono provocare problemi su scala locale. Nelle isole Canarie le popolazioni di D. m. canariensis a Tenerife e di D. m. thanneri a Gran Canaria devono fronteggiare la potenziale minaccia dovuta allo sfruttamento delle locali foreste di pini[3].
Note
- ^ a b c d (EN) BirdLife International, Dendrocopos major, su IUCN Red List of Threatened Species, Versione 2020.2, IUCN, 2020.
- ^ Josep del Hoyo, Andrew Elliott, Jordi Sargatal, David A. Christie ed Eduardo de Juana, Family Picidae: Woodpeckers, su Handbook of the Birds of the World Alive, Barcellona, Lynx Edicions, 2013. URL consultato il 13 dicembre 2016.
- ^ a b c d e f g h i j k l m n o p q r s Josep del Hoyo, Andrew Elliott, Jordi Sargatal, David A. Christie ed Eduardo de Juana, Great Spotted Woodpecker (Dendrocopos major), su Handbook of the Birds of the World Alive, Barcellona, Lynx Edicions, 2013. URL consultato il 14 dicembre 2016.
- ^ (LA) Carl Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata, Holmiae [Stoccolma], Laurentii Salvii, 1758, p. 114.
- ^ (DE) Carl Ludwig Koch, System der baierischen Zoologie, vol. 1, Norimberga, Stein, 1816, p. 72.
- ^ James A. Jobling, The Helm Dictionary of Scientific Bird Names, Londra, Christopher Helm, 2010, pp. 133, 238, ISBN 978-1-4081-2501-4.
- ^ a b c Gorman, 2014, pp. 265-267.
- ^ Jirí Mlíkovský, Cenozoic Birds of the World (PDF), Part 1: Europe, Praga, Ninox, 2002, p. 150. URL consultato il 28 settembre 2017 (archiviato dall'url originale il 7 marzo 2011).
- ^ Cécile Mourer-Chauviré, Michel Philippe, Yves Quinif, Jean Chaline, Evelyne Debard, Claude Guérin e Margarite Hugueney, Position of the palaeontological site Aven I des Abîmes de La Fage, at Noailles (Corrèze, France), in the European Pleistocene chronology, in Boreas, vol. 32, n. 3, 2003, pp. 521-531, DOI:10.1111/j.1502-3885.2003.tb01232.x.
- ^ a b Lars Johnsson, Birds of Europe with North Africa and the Middle East, Londra, A&C Black, 1992, p. 346, ISBN 0-7136-8096-2.
- ^ a b Richard Porter e Simon Aspinal, Birds of the Middle East, Helm Field Guides, Londra, Christopher Helm, 2010, p. 214, ISBN 978-0-7136-7602-0.
- ^ Stanley Cramp et al., Dendrocopos major Great Spotted Woodpecker, in Handbook of the birds of Europe the Middle East and North Africa. The Birds of the Western Palearctic. Volume 4: Terns to Woodpeckers, Oxford, Oxford University Press, 1985, pp. 856-873 [871], ISBN 0-19-857507-6.
- ^ a b c d e f David Snow e Christopher m. Perrins, The Birds of the Western Palearctic concise edition (2 volumes), Oxford, Oxford University Press, 1998, pp. 993-996, ISBN 0-19-854099-X.
- ^ Mark Brazil, Birds of East Asia, Londra, A. & C. Black, 2009, p. 284, ISBN 0-7136-7040-1.
- ^ a b Mark Cocker e Richard Mabey, Birds Britannica, Londra, Chatto & Windus, 2005, pp. 306–307, ISBN 0-7011-6907-9.
- ^ Gordon D'Arcy, Ireland's Lost Birds, Dublino, Four Courts Press, 1999, pp. 113-114, ISBN 978-1-85182-529-5.
- ^ A. M. G. McComb, R. Kernohan, P. Mawhirt, B. Robinson, J. Weir e B. Wells, Great spotted woodpecker (Dendrocopos major): proof of breeding in Tollymore Forest Park, Co. Down, in Irish Naturalists' Journal, vol. 31, 2010, pp. 66-67.
- ^ K. Fahy (per conto della Irish Rare Birds Committee), Report of the Irish Rare Breeding Birds Panel 2013, in Irish Birds, vol. 10, 2014, pp. 68-69.
- ^ Allan D. Mcdevitt, Łukasz Kajtoch, Tomasz D. Mazgajski, Ruth F. Carden, Ilaria Coscia, Christian Osthoff, Richard H. Coombes e Faith Wilson, The origins of Great Spotted Woodpeckers Dendrocopos major colonizing Ireland revealed by mitochondrial DNA, in Bird Study, vol. 58, n. 3, 2011, pp. 361-364, DOI:10.1080/00063657.2011.582619.
- ^ Gorman, 2014, p. 18.
- ^ a b c d Katrina van Grouw, The Unfeathered Bird, Princeton, Princeton University Press, 2012, pp. 74-79, ISBN 978-0-691-15134-2.
- ^ L. J. Gibson, Woodpecker pecking: how woodpeckers avoid brain injury, in Journal of Zoology, vol. 270, n. 3, 23 febbraio 2006, pp. 462-465, DOI:10.1111/j.1469-7998.2006.00166.x.
- ^ L. Wang, J. T.-M. Cheung, F. Pu, D. Li, M. Zhang e Y. Fan, Why do woodpeckers resist head impact injury: a biomechanical investigation, in PLoS ONE, vol. 6, n. 10, 2011, p. e26490, Bibcode:2011PLoSO...626490W, DOI:10.1371/journal.pone.0026490.
- ^ Tomasz D. Mazgajski, Does the Great Spotted Woodpecker Dendrocopos major select holes for roosting? (PDF), in Polish Journal of Ecology, vol. 50, n. 1, 2002, pp. 99-103.
- ^ Robert Burton, Garden Bird Behaviour, Londra, New Holland, 2006, p. 77, ISBN 978-1-84537-597-3.
- ^ a b c K. G. Michalek e J. Miettinen, Dendrocopos major Great Spotted Woodpecker, in BWP Update, vol. 5, n. 2, 2003, pp. 101-184.
- ^ David E. Glue e Tim Boswell, Comparative nesting ecology of the three British breeding woodpeckers (PDF), in British Birds, vol. 87, n. 6, 1994, pp. 253-269. URL consultato il 28 settembre 2017 (archiviato dall'url originale l'11 febbraio 2017).
- ^ Gorman, 2014, pp. 20-22.
- ^ Shigeru Matsuoka, [59:WHINTO2.0.CO;2 Wood hardness in nest trees of the Great Spotted Woodpecker Dendrocopos major], in Ornithological Science, vol. 7, n. 1, 2008, pp. 59-66, DOI:10.2326/1347-0558(2008)7[59:WHINTO]2.0.CO;2.
- ^ a b c Great Spotted Woodpecker Dendrocopos major [Linnaeus, 1758], su BTOWeb BirdFacts, British Trust for Ornithology. URL consultato il 19 gennaio 2016.
- ^ Tom Waters, How often do great spotted woodpeckers eat other birds' chicks?, su rspb.org.uk, RSPB, 2 giugno 2011. URL consultato il 7 aprile 2017.
- ^ Christopher Perrins e Sir David Attenborough, New Generation Guide to the Birds of Britain and Europe, Austin, University of Texas Press, 1987, p. 16, ISBN 978-0-292-75532-1.
- ^ Bogumila Jedrzejewska e Wlodzimierz Jedrzejewski, Predation in Vertebrate Communities: The Bialowieza Primeval Forest as a Case Study, Berlino, Springer, 1998, pp. 252-254, ISBN 978-3-540-64138-4.
- ^ Miriam Rothschild e Theresa Clay, Fleas, Flukes and Cuckoos. A study of bird parasites, New York, Macmillan, 1957, pp. 163, 189, 222.
- ^ Pikka Jokelainen e Turid Vikøren, Acute Fatal Toxoplasmosis in a Great Spotted Woodpecker (Dendrocopos major), in Journal of Wildlife Diseases, vol. 50, n. 1, 2014, pp. 117-120, DOI:10.7589/2013-03-057, PMID 24171576.
- ^ Claude Combes e Daniel Simberloff, The Art of Being a Parasite, Chicago, University of Chicago Press, 2008, p. 68, ISBN 978-0-226-11429-3.
Bibliografia
- Gerard Gorman, Woodpeckers of the World, Helm Photographic Guides, Londra, Christopher Helm, 2014, ISBN 978-1-4081-4715-3..
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Dendrocopos major
Wikimedia Commons contiene immagini o altri file su Dendrocopos major Wikispecies contiene informazioni su Dendrocopos major
Wikispecies contiene informazioni su Dendrocopos major
Collegamenti esterni
- Dendrocopos major, in Avibase - il database degli uccelli nel mondo, Bird Studies Canada.
- Ageing and sexing (PDF; 5.3 MB) by Javier Blasco-Zumeta & Gerd-Michael Heinze.
- Xeno-canto: audio recordings of the great spotted woodpecker.
- Feathers of Great spotted woodpecker (Dendrocopos major) Archiviato il 4 marzo 2018 in Internet Archive..
| Controllo di autorità | GND (DE) 4201716-6 · J9U (EN, HE) 987007540906005171 |
|---|


![Picchio rosso maggiore [photo credit: www.flickr.com/photos/15251430@N03/28369679510Sittingvia photopincreativecommons.org/licenses/by-nc-nd/2.0/]](https://www.treviambiente.it/ambienteebiodiversita/wp-content/uploads/sites/9/2016/09/28369679510_b19f80efcb_b-560x560.jpg)



